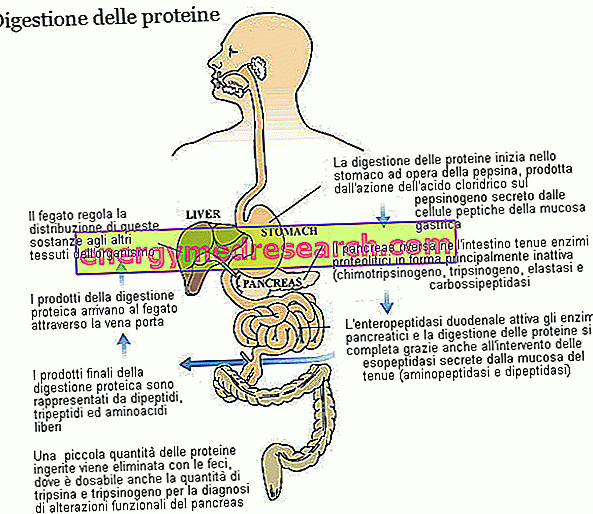
Trypsin dan chymotrypsin adalah dua enzim utama dalam pencernaan protein pemakanan. Kedua-duanya dihasilkan dan dirembeskan sebagai zymogens, iaitu dalam bentuk tidak aktif, oleh pankreas; Prekursor zymogen trypsin dipanggil trypsinogen, sementara itu chymotrypsin dipanggil chymotrypsinogen.
Trypsin dan chymotrypsin tergolong dalam keluarga besar enzim proteolitik (yang terlibat dalam pencernaan protein) dan kepada subkumpulan endopeptidase. Bahan-bahan ini - termasuk elastase pepsin dan pankreas - menyerang ikatan peptida dalam rantai asid amino, menimbulkan serpihan molekul yang lebih kecil. Enzim kepunyaan kumpulan kedua, iaitu exopeptidase, menyelesaikan kerja trypsin dan chymotrypsin, menghilangkan asid amino individu dari hujung rantaian peptida; Karboksipeptida pancreatic (A1, A2 dan B, yang menyerang carboxyl end) adalah milik keluarga ini, tetapi juga aminopeptidases (yang menyerang akhir aminoterminal) dan dipeptidases, kedua-duanya dihasilkan dan dirembeskan oleh mukosa usus kecil. Sesetengah carboxypeptidases, sama seperti yang dilihat untuk trypsin (trypsinogen) dan chymotrypsin (chymotrypsinogen), disekat oleh pankreas dalam bentuk tidak aktif. Dalam ketiga-tiga kes, enzim yang terlibat dalam proses pengaktifan enzimatik ialah enteropeptidase, protein yang dihasilkan dan dirembes oleh sel mukosa duodenal; Lebih khusus lagi, enteropeptidase adalah khusus untuk trypsinogen, yang sekali diubah menjadi trypsin juga mengaktifkan enzim proteolitik lain, termasuk trypsinogen itu sendiri.
Perbezaan fungsi antara trypsin dan chymotrypsin hanya berkaitan dengan kekhususan mereka, iaitu keupayaan untuk mengenali dan memecah hanya ikatan yang dibentuk oleh asid amino yang jelas. Trypsin campur tangan terutama pada ikatan peptida yang melibatkan asid amino asas (seperti arginin dan lisin), manakala chymotrypsin menghidrolisis terutamanya ikatan yang melibatkan tirosin, fenilalanin, tryptophan, leucine dan methionine.
Terima kasih kepada pelbagai enzim proteolitik, dengan sumbangan keasidan gastrik, protein pemakanan - yang asalnya dibentuk oleh beberapa puluh asid amino - dipecah menjadi peptida, tripeptida dan asid amino bebas, semua bahan mudah diserap yang dari kapilari mukosa usus datang dihantar ke hati.
Trypsin dan chymotrypsin dalam najis
Penentuan chymotrypsin dan trypsin dalam najis digunakan, dan terutama sekali pada masa lalu, sebagai ujian tidak langsung keupayaan fungsional pankreas exocrine. Jika sesuatu tidak berfungsi dengan betul pada tahap kelenjar ini, adalah wajar untuk mengharapkan sintesis dikurangkan trypsin dan chymotrypsin, yang juga akan kekurangan najis. Ujian ini mempunyai sensitiviti yang baik, tetapi dibebani oleh risiko sebenar positif palsu dan negatif palsu. Penggunaan julap, contohnya, mengurangkan kepekatan enzim dalam bahan tahi, sementara pengambilan pengambilan pankreatik pencernaan (seperti pancreatin) atau sayur-sayuran (misalnya tangkai nanas, papaya, papain dan bromelain) menyebabkan keputusan negatif palsu. Juga flora bakteria usus sedikit mempengaruhi kuantiti trypsin dan chymotrypsin yang tiba tidak berubah dalam najis; Atas sebab ini penggunaan antibiotik boleh menghasilkan negatif palsu; sebaliknya, dengan adanya diverticulosis dan keadaan lain yang memihak kepada percambahan bakteria, hasil positif palsu dapat direkam.
Aplikasi klasik trypsin dan chymotrypsin dos dalam feses adalah pengesanan kekurangan pankreas pada pesakit dengan fibrosis sista. Salah satu akibat daripada penyakit ini adalah penurunan kadar pengangkutan trypsin dan enzim pencernaan yang lain dari pankreas ke duodenum; Atas sebab ini, pada saat lahir, najis anak dengan fibrosis sista sangat padat, hingga menyebabkan obstruksi usus. Akibatnya, terutamanya sedikit chymotrypsin dan trypsin dicatatkan dalam meconium.